【英文名称】 Bromine
【分子式】Br₂
【分子量】159.81
【CAS号】7726-95-6
【物理性质】红棕色易挥发液体,bp 59 °C,mp -7 °C,d 3.128 g/cm³。溶于水、乙酸、乙醇、乙醚、氯仿、四氯化碳、二硫化碳以及正戊烷、石油醚等烃类溶剂。
【制备和商品】国内外试剂公司均有销售,商品试剂为纯溴液体或 1.0 mol/L 的四氯化碳溶液。
【注意事项】溴的液体或气体形式都具有强腐蚀性和毒性。须在通风橱中储存、操作和使用。
液溴是一个有效的溴化试剂和氧化试剂,能够引发或参与环化物的开环和重排反应。
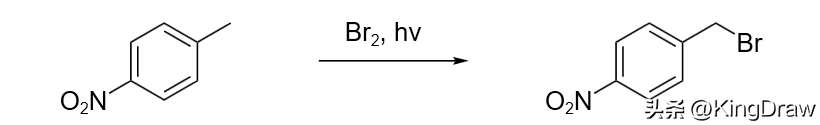
液溴是一个强有力的溴化试剂。虽然对烷烃的溴化反应还存在一定困难,但在光照的自由基反应条件下可以实现苄基位的溴化反应。
在路易斯酸存在下,溴可以对芳烃发生亲电芳基取代反应得到溴代芳烃。由于溴具有较强的吸电子效应,通常的亲电取代反应主要得到单溴化产物。然而,使用苯酚、苯胺和多烷基苯等高活性芳烃底物时,即使没有路易斯酸催化也得到多溴代产物。
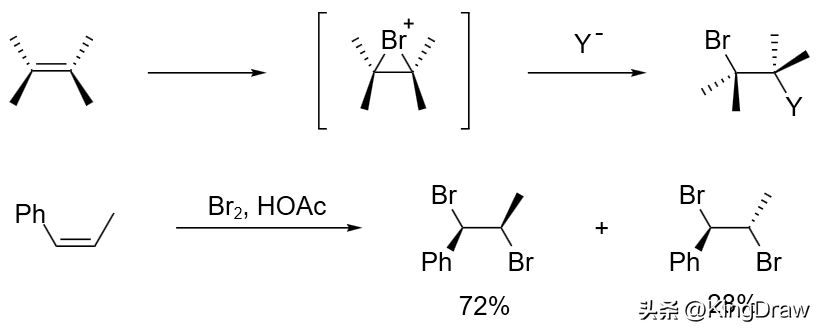
溴对烯烃的加成反应经历了环状溴鎓离子的形成。溴鎓离子被电负性基团 Y⁻ 亲核进攻,得到反式加成产物。溴鎓离子也可以被溴本身进攻,得到反式的二溴化合物。不对称烯烃在形成溴鎓离子时,由于键的强弱不同会立体选择性得到某种溴化产物,并且很容易发生重排反应。冠醚和沸石的存在通常可以提高烯烃溴化反应的选择性。共轭二烯主要生成 1,4-二溴产物,而炔烃则不太容易发生亲电进攻。
溴对烯烃的加成反应还可以作为氧化烯烃至 1,3-丁二烯的第一步反应。也可以通过溴化反应来保护或纯化烯烃,然后再经过消除反应重新得到烯烃。

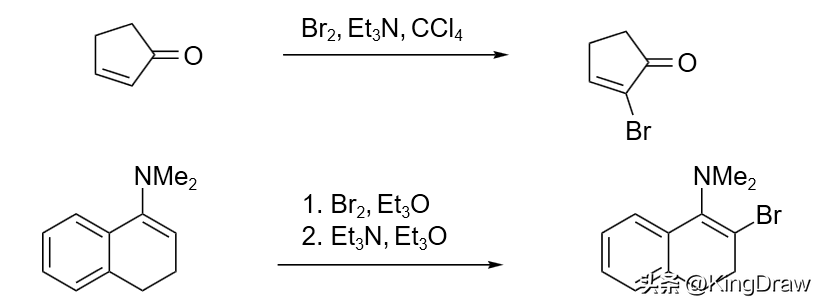
使用一端带有吸电子取代基的烯烃(例如:α,β-不饱和环戊酮)为底物,它们的溴化反应通常会经过溴化/脱溴反应选择性得到 α-溴化产物。使用一端带有给电子取代基的烯烃(例如:烯醇醚、烯胺)为底物时,它们的溴化反应则能选择性得到 β-溴化产物。
烯酸的溴内酯化反应是烯烃溴化反应的一个扩展。通常,在羧酸盐存在下进行的溴内酯化反应都会发生产物的重排。只有在 Hg(II) 盐和溴共同作用下,才能得到正常的溴内酯化反应。采用 NBS 等其它亲电性溴源则生成其它产物。
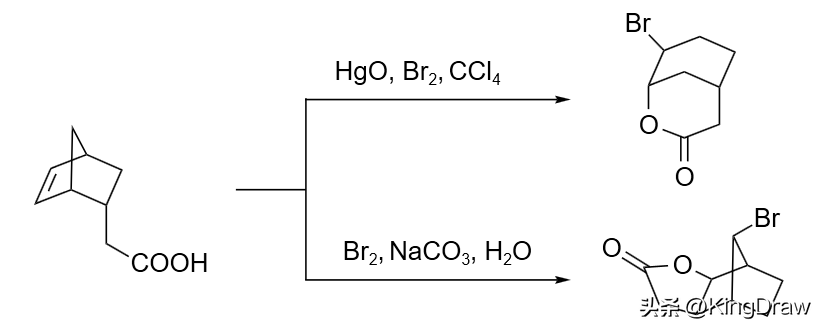
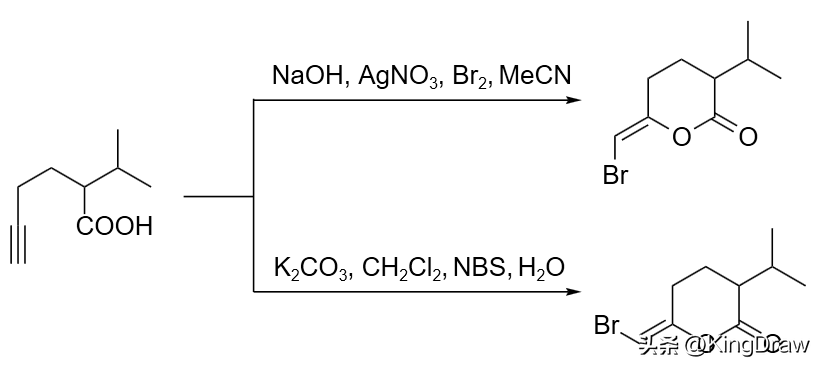
炔酸在溴作用下会发生烯醇内酯化反应,在不同的金属盐诱导和不同的溴源作用下,能得到不同的溴代烯醇异构体。
通常,丙烯酰胺化合物在溴作用下会环化生成内酯化合物。但当氨基氮上带取代基时,能够发生溴代内酯化反应。这是由于氮上取代基的引入会降低底物的水解常数,从而抑制了底物的水解。
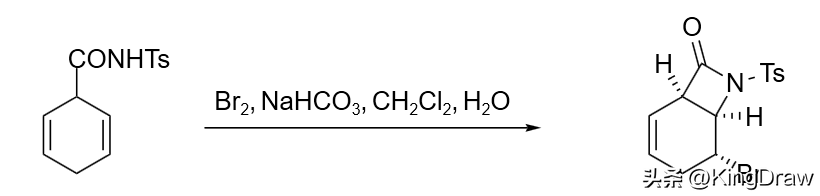
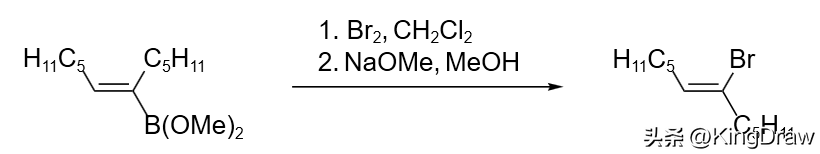
溴还可以用于有机金属试剂的溴化反应,有机镁、有机锂和有机铝都能同溴反应得到金属被溴取代的产物。有机硼试剂能与溴以多种方式反应;在甲醇钠存在下,生成相应的烷基溴化物;还可发生光溴化反应首先得到 α-溴化有机硼,进而得到烷基溴化物或重排得到新的有机硼试剂。有机硼在溴作用下也可发生构象翻转,例如:硼酸酯与溴反应得到构象翻转的溴化产物。
溴参与的另一类重要反应是氧化反应,例如:将仲醇氧化为酮。伯醇在溴作用下可以被氧化为醛或者酯,其中一个有趣的反应是溴将缩醛氧化为酯的反应。

溴与其它试剂生成的组合试剂可以显示出特异的氧化性,例如:Br₂/HMPA 或 Br₂/HBD 能选择性地氧化仲醇,而 Br₂/羧酸镍则能通过选择性氧化伯醇将 1,4-二醇转换为 γ-丁内酯。
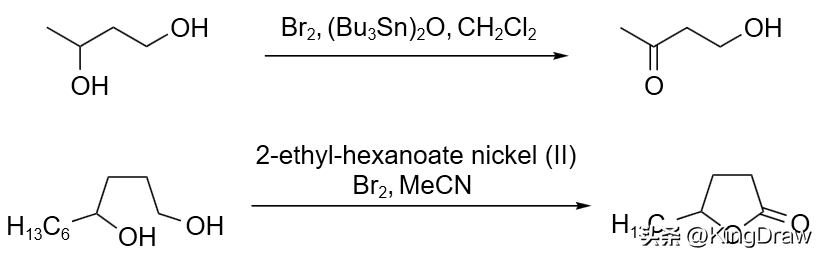
溴能与许多官能团反应导致键的断裂或骨架重排。在经典的 Hofmann 反应中,依据不同的反应条件,伯酰胺与溴在碱存在下反应得到异氰酸酯、氨基甲酸酯或酰胺。
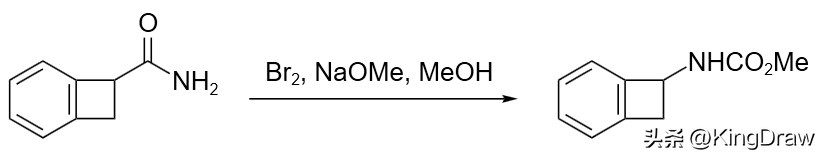
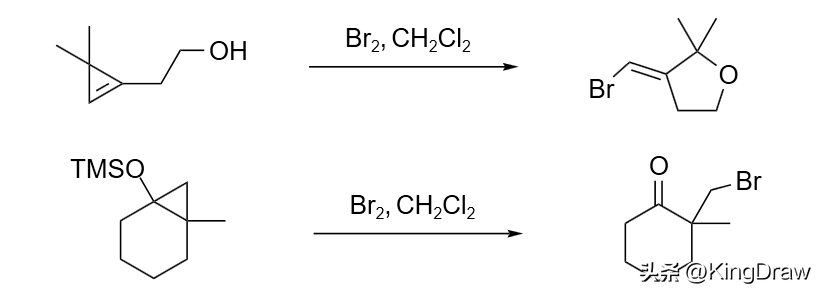
三元环对溴非常敏感。在溴作用下,环丙烷会开环生成 1,3-二溴丙烷、环丙烯乙醇发生重排生成 3-亚甲基四氢呋喃,而三甲基硅环丙酯则会开环得到 β-溴化酮。