1、【工业制取CO2 】
反应原理:高温煅烧石灰石
高温煅烧石灰石:CaCO3=高温= CaO+CO2↑
另:生石灰可以与水反应生成熟石灰:CaO+H2O===Ca(OH)2
2、【实验室制取CO2】
大理石(石灰石)与稀盐酸反应:CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
(1)误区警示:实验药品的选择
①不能选用浓盐酸:浓盐酸具有很强的挥发性,在盐酸与碳酸钙反应的过程中盐酸挥发产生氯化氢,氯化氢随二氧化碳进入到收集装置,从而得不到纯净的二氧化碳。
②不能选用硫酸:硫酸与碳酸钙反应的生成物会附着在碳酸钙上,阻止反应继续发生。
③不能用碳酸钠、碳酸钾代替大理石或石灰石:防止反应速度过快导致难以收集气体。
(2)对发生装置和收集装置选取的总结

分析制取二氧化碳和氧气的性质选择装置:
反应物的状态 | 反应条件 | 与空气密度比较 | 溶解性 | |
二氧化碳 | 大理石(固)和稀盐酸(液) | 常温 | 比空气大 | 能溶于水 |
氧气 | 高锰酸钾(固)或双氧水(液)及氯酸钾(固) | 加热或常温 | 比空气大 | 不易溶于水 |
(3)制取氧气反应及收集装置
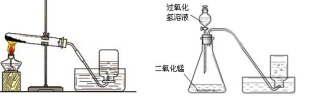
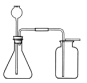
(4)制取二氧化碳反应及收集装置
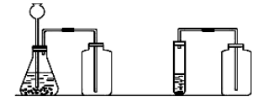
注:A长颈漏斗下端必须伸到液面以下,形成液封,防止生成的气体从长颈漏斗口逸出
B 伸入集气瓶中的导气管末端必须接近瓶底,以排尽瓶内的空气。
(5)实验步骤(查 装 定 加 收 验)
查:按要求连接仪器并检查装置的气密性
装:装入大理石,塞紧橡皮塞
定:把反应装置固定好
加:从长颈漏斗加入稀盐酸至浸没长颈漏斗口下端管口
收:收集气体
验:检验气体是否收集满
